Kovalent Bağlar Nedir?
İyonlaşma enerjisi çok yüksek olan elementler elektron transfer edemezler ve çok düşük elektron ilgisine sahip elementler elektron alamazlar. Bu tür elementlerin atomları, elektronlarını diğer elementlerin atomlarıyla veya aynı elementin diğer atomlarıyla, her iki atomun da kendi değerlik kabuğunda oktet konfigürasyonu elde edecek ve böylece stabilite sağlayacak şekilde paylaşma eğilimindedir. Elektron çiftlerinin farklı veya aynı türler arasında paylaşılması yoluyla bu tür bir ilişki, Kovalent Bağ olarak bilinir.
Kovalent Bağlanma İki Yolla Elde Edilebilir:
1. Aynı tür atomlar arasında elektron paylaşımı Ör. H 2 , Cl 2 , O 2, vb. oluşumu .
2. Elektronların farklı türdeki atomlar arasında paylaşımı Örn. CH 4 , H 2 O, NH 3, vb. oluşumu
Kovalent Bağın Özellikleri
Bir atomun normal değerliliği, atomlar arasında tek bir elektron çifti paylaşılarak karşılanmıyorsa, atomlar aralarında birden fazla elektron çifti paylaşabilir. Kovalent bağların bazı özellikleri şunlardır:
• Kovalent bağ, yeni elektronların oluşumuna neden olmaz. Bağ sadece onları eşleştirir.
• Atomlar arasında var olan çok güçlü kimyasal bağlardır.
• Bir kovalent bağ normalde mol başına yaklaşık ~80 kilokalori (kcal/mol) enerji içerir.
• Kovalent bağlar oluştuktan sonra nadiren kendiliğinden kopar.
• Kovalent bağlar, bağlanan atomların birbirine göre belirli yönelimleri gösterdiği yerde yönlüdür.
• Kovalent bağlara sahip bileşiklerin çoğu, nispeten düşük erime noktaları ve kaynama noktaları sergiler.
• Kovalent bağlı bileşikler genellikle daha düşük buharlaşma ve füzyon entalpilerine sahiptir .
• Kovalent bağ ile oluşan bileşikler, serbest elektron eksikliğinden dolayı elektriği iletmezler.
• Kovalent bileşikler suda çözünmezler.
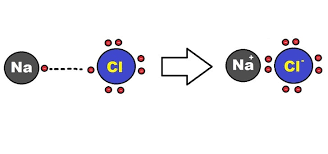
Oktet Kuralı Nedir?
Soy gazlar dışındaki tüm atomların değerlik kabuğunda sekizden az elektron bulunur. Başka bir deyişle, bu atomların değerlik kabukları kararlı konfigürasyonlara sahip değildir. Bu nedenle, kararlı elektronik konfigürasyonlar elde etmek için birbirleriyle veya diğer atomlarla birleşirler. Bu nedenle, çeşitli elementlerin atomlarının değerlik kabuklarında sekiz elektronun kararlı konfigürasyonunu elde etme eğilimi, Kimyasal kombinasyonun nedenidir ve atomların değerlik kabuğunda maksimum sekiz elektron elde etme ilkesine oktet kuralı denir.
Lewis, değerlik elektronları olarak bilinen atomun dış kabuğunda bulunan elektronları belirtmek için basit semboller getirdi. Bu semboller Elektron Nokta Sembolleri olarak bilinir ve bileşiğin yapısı Lewis Nokta Yapısı olarak bilinir. Lewis nokta yapılarını yazmak için koşullar şunlardır.
• Atomlar arasında bir elektron çiftinin paylaşılması, kovalent bağların oluşumuyla sonuçlanır.
• Bağ oluşumu sırasında, her bağ, birleşen atomların her birinin katkıda bulunduğu iki elektrondan oluşur.
• Elektronların karşılıklı paylaşımıyla, her atom değerlik kabuğunda sekizli konfigürasyona ulaşır.
Kovalent moleküllerin elektron nokta yapıları oktet kuralına göre yazılır . Bu kurala göre, moleküldeki tüm atomların değerlik kabuğunda Hidrojen atomu hariç sekiz elektron olacaktır. Hidrojenin sadece iki elektronu olacaktır, çünkü sadece iki elektron helyum konfigürasyonunu elde etmek için ilk kabuğunu tamamlar.
Böylece, Cl gibi grup 17’nin elemanları, kararlı oktet elde etmek için bir elektronu paylaşacaktır; O ve S gibi grup 16’nın elemanları iki elektronu paylaşır; 15. grubun elemanları üç elektronu paylaşır. Örneğin değerlik kabuğunda altı elektron bulunan oksijen atomu, iki elektronunu iki hidrojen atomuyla paylaşarak bir su molekülü oluşturarak oktetini tamamlar.
Kovalent Bağ TürleriKovalent Bağlar Nedir?
Paylaşılan elektron çiftlerinin sayısına bağlı olarak, kovalent bağ şu şekilde sınıflandırılabilir:
• Tek Kovalent Bağ
• Çift Kovalent Bağ
• Üçlü Kovalent Bağ
Tek Kovalent Bağ
Tek bir bağ, katılan iki atom arasında yalnızca bir elektron çifti paylaşıldığında oluşur. Bir tire (-) ile gösterilir. Bu kovalent bağ biçimi, daha küçük bir yoğunluğa sahip olmasına ve ikili ve üçlü bağlardan daha zayıf olmasına rağmen, en kararlı olanıdır. Örneğin, HCL amolekülü, bir değerlik elektronlu bir Hidrojen atomuna ve yedi değerlik elektronlu bir Klor atomuna sahiptir. Bu durumda hidrojen ve klor arasında bir elektron paylaşılarak tek bir bağ oluşur.
İnsanlar yaşamları boyunca diğer insanlarla iletişimde bulun...
Bayanlar ilişkilerinde daha karmaşık gibi görünsede, erkekle...
Askerlik yapacak gençlerin üniversite mezunu olduktan sonra ...
Ülkemizde de güzel birçok yer elbette bulunmaktadır. Ancak d...
Her birini kendimiz seçtiğimiz bilgisayar masaüstü fotoğrafl...
Doğum günü partisi planlamak istediğinizde bütçenize göre bi...
Ankara, sadece Türkiye’nin siyasi merkezi değil, aynı zamand...
Tunç ÜNAL Şifa Enerjileri konularında adeta bir dijital şifa...
Tamanu yağının ne olduğunu, nasıl yapıldığını, kullanım alan...
Jandarma ekipleriyle yürütülen titiz çalışma sonucunda, inşa...
Bazen minik yavrularımızın bazı hareketleri bizi telaşlandır...
Kocaeli merkezli firmamız, kiralık fabrika vidanjör hizmetle...
Akne ile mücadele için kullanılan yüz temizleyiciler, jeller...
Masaüstü yapmak istediğiniz ilginç fotoğrafları sizlere sunm...
Evet kadınları anlamak bazen zor olabiliyor ancak erkeklerle...




